通過微調底物結合口袋實現環氧化物水解酶的區域選擇性轉換,以合成(R)-和(S)-苯基-1,2-乙二醇
頂
- 分類:行業動態
- 發布時間:2024-12-10 13:04
- 訪問量:
【概要描述】環氧化物水解酶(Epoxide hydrolase, EHs, EC3.3.2.-)普遍存在於(yu) 各種生命形式中,能特異性地水解外消旋環氧底物,並生成相應的手性1,2-二醇。
通過微調底物結合口袋實現環氧化物水解酶的區域選擇性轉換,以合成(R)-和(S)-苯基-1,2-乙二醇
頂
【概要描述】環氧化物水解酶(Epoxide hydrolase, EHs, EC3.3.2.-)普遍存在於(yu) 各種生命形式中,能特異性地水解外消旋環氧底物,並生成相應的手性1,2-二醇。
- 分類:行業動態
- 發布時間:2024-12-10 13:04
- 訪問量:
環氧化物水解酶(Epoxide hydrolase, EHs, EC3.3.2.-)普遍存在於(yu) 各種生命形式中,能特異性地水解外消旋環氧底物,並生成相應的手性1,2-二醇(如圖1)。手性環氧化物和1,2-二醇是合成高價(jia) 值藥物的關(guan) 鍵中間體(ti) ,例如,(R)-苯基-1,2-乙二醇((R)-PED)是合成芳基烷基胺鈣化劑(R)-(+)-NPS R-568的前體(ti) ,(S)-PED可用於(yu) 生產(chan) KDMSO抑製劑。然而,天然EHs對環氧化物底物的兩(liang) 種對映體(ti) 的區域選擇性普遍較差,且EHs的分子修飾能夠達到完全逆轉其區域選擇性的案例較少。

因此,本文通過計算機輔助設計,對來自Rhodotorula paludigena JNU001的環氧化物水解酶(RpEH)的底物結合袋(SBP)內(nei) 特定殘基進行靶向突變。並研究了RpEH突變體(ti) 催化苯乙烯氧化物(SO)進行區域選擇性水解的工業(ye) 應用。此外,作者通過分子動力學(MD)模擬,初步解釋了RpEH-I194F對(S)-SO的區域選擇性逆轉的機製。
具體(ti) 的研究過程如下:
利用RpEH的濕細胞催化rac-SO進行水解反應,可生成(R)-苯基-1,2-乙二醇,轉化率為(wei) 93.6%,說明該酶對R構型產(chan) 物有立體(ti) 選擇性,產(chan) 物ee值為(wei) 67.8%。同時測定了(S)-和(R)-SO的區域選擇性係數αS和βR值(計算公式如下[1])。結果表明,RpEH具有較高的βR值(90.8%),對(S)-SO區域選擇性係數αS值(77.0%)較低。
(R)-SO的區域選擇性係數用αR和βR表示,αR=[Sp/(Rp+Sp)]×100%,αR+βR=100%;
其中,Rp和Sp分別表示R型產(chan) 物和S型產(chan) 物的濃度。
將194和360位點的殘基分別替換為(wei) Ala、Phe、Ile、Leu、Met、Asn、Val、Trp和Tyr,轉化至大腸杆菌BL21(DE3)中,而後將重組菌體(ti) 進行培養(yang) 、誘導表達。通過RpEH野生型(WT)及突變體(ti) 酶對rac-SO底物的水解反應,最終篩選到了2個(ge) 較優(you) 突變體(ti) RpEH-L360V和RpEH-L360F,比WT的水解活性分別提高了102%和114.4%(如圖2)。
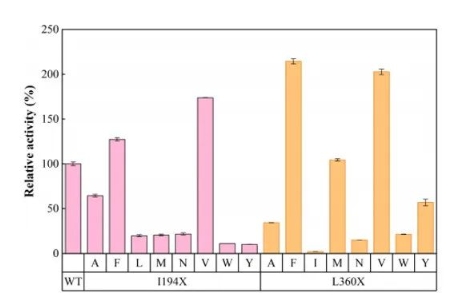
表1. RpEH野生型(WT)及其突變體(ti) 對rac-SO的轉化率、
ee值和區域選擇性係數
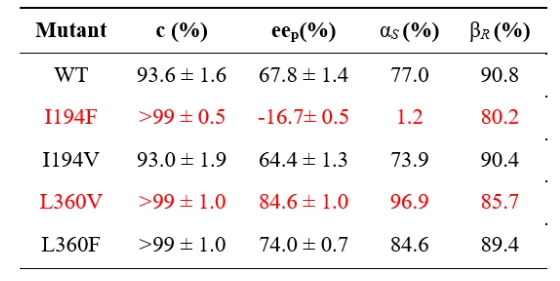

圖3. RpEH(左)和RpEH-I194F(右)
RpEH-I194F攻擊原子的改變是因為(wei) 在RpEH-I194F-(S)-SO中,Ile194被Phe取代,改變了鄰近Trp191的構象,增加了其與(yu) (S)-SO的Pi-Pi相互作用的頻率,這些頻繁的分子間相互作用引起了(S)-SO的構象變化,使其Cβ原子更靠近親(qin) 核Asp190(如圖4),從(cong) 而逆轉RpEH-I194F的區域選擇性。
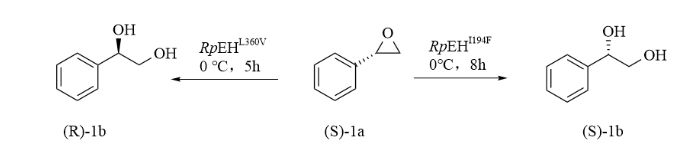
圖4. RpEH和RpEH-I194F與(yu) (S)-SO的
由於(yu) 突變體(ti) RpEH-L360V具有較高的αS值(96.9%),而RpEH-I194F具有較高的βS值(98.8%),且均具有較高的催化活性,因此將這兩(liang) 個(ge) 突變體(ti) 分別應用於(yu) 底物(S)-1a的區域選擇性水解反應,以合成手性苯基-1,2-乙二醇((R)-1b和(S)-1b),具體(ti) 反應路線如圖5。

(S)-環氧化物1a水解的反應路線
表2.RpEH-L360V和RpEH-I194F的最佳反應條件及結果

本文總結:本文通過對環氧化物水解酶(RpEH)的定點突變以調節突變體(ti) 的區域選擇性,最終篩選得到2個(ge) 突變體(ti) RpEH-L360V和RpEH-I194F,他們(men) 的催化活性高,且具有不同的區域選擇性。將RpEH-L360V和RpEH-I194F分別應用於(yu) (R)-和(S)-苯基-1,2-乙二醇的克級合成,均獲得了大於(yu) 99%轉化率。此外,本文還通過MD模擬初步分析了突變體(ti) RpEH-I194F區域選擇性逆轉的機製。
參考文獻:
搜索


-
-

